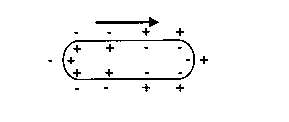BASES ANATOMOFISIOLOGICAS DEL CORAZÓN.
El aparato cardiovascular, formado por el corazón como órgano central, y su complejo sistema de vasos (arterias y venas) es el encargado de llevar a todos los órganos y tejidos de la economía, la sangre con sus nutrientes y el oxigeno que necesitan para un adecuado metabolismo, al mismo tiempo como sistema unidireccional, recoge los productos de desechos para su futura excreción.
Localización:
El corazón se localiza en la parte inferior del mediastino medio, entre el segundo y el quinto espacio intercostal izquierdo, situado de forma oblicua aproximadamente dos tercios a la izquierda del plano medio y un tercio a la derecha. Tiene forma de pirámide inclinada con el vértice hacia el suelo, en sentido anterior izquierdo, la base, opuesta a la punta, en sentido posterior, y tres lados 1) cara diafragmática, sobre la que descansa la pirámide, 2) cara esternocostal, anterior y 3) cara pulmonar hacia la izquierda.
Morfología:
Se divide en cuatro cámaras, dos superiores o aurículas y dos inferiores o ventrículos.
La aurícula derecha o atrio derecho, recibe la sangre poco oxigenada que proviene de todos los órganos y tejidos del cuerpo, a través del sistema venoso, llegando a ella por medio de la vena cava superior e inferior; esta a su ves hace llegar la sangre al ventrículo derecho atravesando la válvula tricúspide, luego será impulsada hacia los pulmones para su oxigenación, utilizando como vía de salida el tronco arterial pulmonar. Una vez oxigenada, regresa mediante las venas pulmonares a la aurícula izquierda o atrio izquierdo, de aquí a través de la válvula mitral, alcanzara el ventrículo izquierdo, el cual es el encargado de enviarla de regreso a toda la economía del organismo, usando la arteria aorta para su distribución.
El corazón, órgano muscular hueco situado como ya sabemos en el medio de la cavidad torácica, es el encargado de bombear la sangre, este conjunto muscular denominado miocardio presenta un grupo de propiedades fundamentales que le permiten llevar a cabo su función de bomba.
1) Automatismo o Cronotropismo: esta propiedad esta presente en todo el miocardio, pero la encontramos altamente desarrollada, en el sistema especifico o marcapaso, y el sistema de conducción, es la propiedad que tiene el miocardio de producir estímulos rítmicos.
2) Conductibilidad o Dromotropismo: las fibras miocárdicas son capaces de recibir y trasmitir estímulos eléctricos.
3) Excitabilidad o Bathmotropismo: también común a toda la musculatura estriada, pero con sus características especiales en el miocardio, debido a la presencia de un periodo refractario mas prolongado, existe la capacidad de reaccionar frente a estímulos determinados.
4) Contractibilidad o Inotropismo: es la propiedad del músculo, tanto liso como estriado de contraerse.
5) Refractariedad: consiste en que tras una excitación, existe un intervalo de tiempo en que la fibra es incapaz de responder a un nuevo estimulo, independientemente de la intensidad de este, esta propiedad también esta generalizada a toda célula cardiaca.
Partiremos del conocimiento que tenemos de que en toda célula que se encuentra en reposo, hallaremos un conjunto de cargas dispuestas de forma organizada a ambos lados de la membrana, estando las positivas por fuera y las negativas en el interior, esta disposición es debido también al equilibrio iónico entre el medio extra e intra celular.
Fig. 2. Membrana celular en reposo.
La membrana celular es permeable al potasio, pero relativamente impermeable al sodio. A través de la bomba Na-K ATPasa se consigue una concentración intracelular de sodio baja, mientras que la de potasio se mantiene elevada. Los movimientos de la salida de potasio de la célula, y la reducción de su gradiente producen pérdida neta de cargas positivas en el interior de la célula, se establece así un potencial eléctrico a través de la membrana, que como habíamos mencionado anteriormente, el interior de la célula quedaría negativo en relación al ambiente extracelular. Este potencial de membrana en reposo representa el equilibrio entre dos fuerzas opuestas: movimiento de potasio en contra de su gradiente de concentración y la atrición eléctrica del espacio intracelular con carga negativa hacia los iones de potasio con carga positiva.
Cuando el potencial de membrana se vuelve menos negativo sobrepasando los valores umbrales, de -60mV aproximados para células de los nódulos seno-auricular y auriculo-ventricular, y de -90mV para células auriculares, ventriculares y el sistema His-Purkinje; se desarrolla un potencial de acción característico que aumenta de forma transitoria el potencial de membrana hasta + 20mV aproximados, conocido como Fase 0 del potencial de acción caracterizado por un ascenso rápido, y que en el caso de los ventrículos, incluyendo has de His y fibras de Purkinje hay una apertura de los canales de sodio, en el caso de las células del nodo sino-auricular y auriculo-ventricular, se abren los canales de calcio, estas células carecen de canales de sodio, lo cual produce una velocidad de conducción lenta, que será utilizada por el nodo auriculo-ventricular para prolongar la transmisión del impulso eléctrico desde la aurícula a los ventrículos, facilitando así el llenado ventricular.
Luego de esta fase de despolarización comienza la repolarización inicial o Fase 1, donde se cierran los canales para el sodio limitando su entrada, y comienzan a abrirse los de potasio. Seguidamente hay una apertura de los canales para el calcio, facilitando su entrada a la célula, se establece un balance entre la entrada de calcio y la salida del potasio. Este calcio entrante esta dirigido a estimular la liberación de más calcio apartir del retículo sarcoplasmico, para facilitar la contracción del miocito, durante esta etapa se produce una meseta en el potencial de acción correspondiente a la Fase 2 o meseta.
Continua la repolarizacion, esta ves rápida, de la célula o Fase 3, donde al abrirse los canales lentos de potasio, hay una salida importante del mismo al medio extracelular, a su ves se cierran los canales para el calcio, lográndose entonces una negatividad en el interior celular, gracias a la salida del potasio, quedando nuevamente la célula en reposo, Fase 4, justo donde habíamos comenzado, Potencial de Membrana en Reposo.
Seria importante mencionar algunas características del potencial de acción de las células marcapaso (nodo auricular y auriculo-ventricular).
1) Fase 0, ya habíamos mencionado que carecen de canales para el sodio, lo que produce una velocidad de transmisión lenta a nivel del nódulo auriculo-ventricular.
2) Fase 2, no hay fase de meseta.
3) Fase 3, hay in activación de los canales de calcio, y apertura de los de potasio, incrementando la salida del potasio.
4) Fase 4, el potencial de membrana se despolariza automáticamente a medida que aumenta la conductancia al sodio. Alcanza valores de -60mV, esta pendiente en la fase 4 en el nodo sino-auricular determinara la frecuencia cardiaca.
Fig.3 Potencial de acción ventricular y flujo de iones.
Fig.4 Potencial de acción. Células marcapaso.
Al estado de inactividad celular se le denomina Estado de polarización (Fig.2), y a la diferencia entre los potenciales a ambos lados de la membrana se le denomina Potencial trasmembrana de reposo, el cual en las células que componen los nódulos sinusal y aurícula-ventricular puede llegar hasta -60mV, en las fibras auriculares, ventriculares y del sistema His-Purkinje, como ya habíamos dicho hasta -90mV.
Al estimular una célula que se encuentra en reposo, se produce una onda de excitación que se propaga en forma de ola hacia el lado opuesto al punto de estimulación, proceso en el cual hay una inversión de las cargas eléctricas, donde las positivas se intercambian con las negativas, hasta quedar negativo el exterior y positivo el interior, estado denominado despolarización, en este momento la célula es incapaz de responder a un nuevo estimulo, estado celular conocido como periodo refractario.
Fig.5 Despolarización inicial.
Fig.6 Despolarización total. Estado refractario.
Segundos mas tarde hay una recuperación del estado inicial, que se obtiene de forma progresiva comenzando por el mismo sitio donde se produjo la estimulación, la célula regresa a su estado de reposo, conociéndose esta fase como repolarizacion, pero que a diferencia de lo que sucede en el resto de las células del cuerpo, en el corazón la repolarizacion comienza por el mismo sitio donde termino la despolarización.
Fig.6 Repolarizacion.
Esta secuencia de despolarización y repolarizacion produce la contracción de cada célula estimulada, siendo el resultado final, en el caso del corazón la sístole y diástole que le permiten cumplir con su función de bomba.
Para lograr esta función de bomba el corazón necesita de una contracción adecuada, precisa, ordenada y continua, para esto cuenta con un sistema encargado de sincronizar toda la secuencia de activación de cada una de sus partes, denominada Sistema exitoconductor del corazón (Fig.7), este a su ves esta constituido por varias estructuras.
Nódulo sino-auricular (Keith-Flack): Situado en la aurícula derecha, junto a la desembocadura de la vena cava superior; aquí es donde por lo general nace el impulso que se propagara activando al resto del corazón, es considerado el marcapaso del corazón, tiene la mayor frecuencia de activación, entre 60 y 100 veces por minutos.
Vías internodales: consideradas como fibras musculares normales, que por su tamaño, geometría y características electrofisiológicas facilitan que el impulso se propague más directo y rápido que en el resto del miocardio. Se piensa en la existencia de unos haces por los cuales circulan esto impulsos, pero no se ha podido demostrar anatómicamente, ellos son: uno anterior (Bachmann), uno medio (Wenckebach) y uno posterior (fascículo de Thorel).
Sincitio auricular: toda la pared auricular actúa como tejido de conducción.
Nódulo auriculo-ventricular (Aschoff-Tawara): tiene como función sincronizar la contracción de la aurícula y los ventrículos, organizando la secuencia de la activación de los ventrículos, además de ser la reserva de activación del corazón en caso de que el Nódulo sino-auricular fallase.
El nódulo auriculo-ventricular esta constituido por tres estructuras, la zona transicional, una porción compacta o nódulo auriculo-ventricular, y una penetrante en el cuerpo fibroso del corazón; existe una transición desde la aurícula al nódulo, y desde este al haz de His, que amplia la estructura del mismo, además de tener propiedades automáticas, a la cual se le denomina zona de la Unión auriculo-ventricular.
Apartir del nódulo auriculo-ventricular comienza el has de His, estructura formada por un conjunto de fibras que conducen el impulso de activación hacia los ventrículos, tienen propiedades automáticas y frecuencia fisiológica que oscila entre 35 a 45 por minutos. Este haz atraviesa el tabique del corazón asomando en el lado izquierdo del tabique interventricular, a este nivel se divide dando lugar a la rama izquierda, que a su ves esta formada por dos fascículos, el antero-lateral y el postero-inferior; a nivel del tabique membranoso se forma la rama derecha.
El haz de His con sus ramas y fascículos termina en la base de los músculos papilares de los ventrículos contactando con la red de Purkinje, células especializadas en la conducción del impulso eléctrico distribuidas en la superficie endocardica donde finaliza el acoplamiento del impulso eléctrico con las células contráctiles. También tienen automatismo con una frecuencia de 20 a 35 por minutos.
En resumen, en condiciones normales el impulso eléctrico del corazón se inicia a nivel del nódulo sino-auricular de forma automática y repetida, que se extenderá por todo el tejido circundante produciéndose múltiples vectores de activación que viajan en diferentes direcciones activando ambas aurículas, la sumatoria de estos vectores dará como resultado un vector que se dirige, de arriba hacia abajo, y de derecha a izquierda; y algo de atrás hacia delante.
Después de activa y despolarizada la aurícula, este impulso eléctrico se dirige al nódulo auriculo-ventricular, el cual seria su vía para alcanzar los ventrículos, de aquí y experimentando un ligero retraso, continua su propagación al haz de His, sus ramas y red de Purkinje, llegando a cada una de las células contráctiles.
Una vez ocurrida la despolarización comienza la repolarizacion, tanto en ventrículo como en aurículas, pero como se menciona anterior, a diferencia de lo que sucede en el resto de las células, en el corazón la repolarizacion comienza por el mismo sitio donde termino la despolarización.
Fig.7. Sistema exitoconductor del corazón.
Dr. Jeovanny Almanza 08/07/2011